В своем развитии микроскопия за несколько веков прошла ряд важных этапов, каждый из которых существенно раздвигал границы возможного для наблюдений и изучения. Довольно долго ученые пытались найти подходящие инструменты для изучения составных частей клетки: белков, ДНК и РНК. В 1960-х годах XX века первые работы такого рода в Москве публиковал член-корреспондент АН СССР Николай Киселев, который пробовал изучать биологические объекты с помощью электронного микроскопа. Но одним из главных препятствий стала невозможность помещения живого объекта в вакуумную среду (необходимую для работы обычного электронного микроскопа) без специальной обработки, которая в свою очередь ухудшала состояние самого объекта.
Были свои ограничения и у других методов, которые ученые пытались применять. Например, для рентгеновской кристаллографии нужны хорошо организованные кристаллы, которые далеко не всегда можно получить.
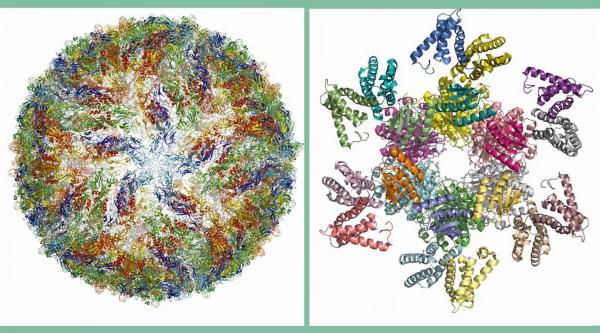
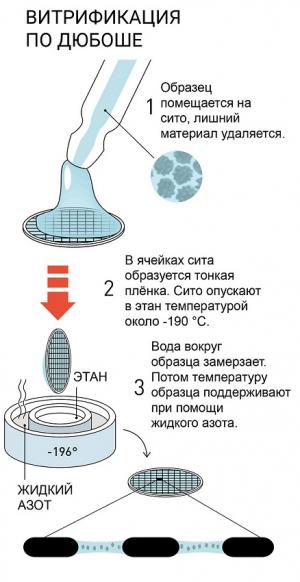
Продвинуться в изучении нефиксированных биологических объектов с помощью электронной микроскопии позволили работы Жака Дюбоше, который в конце 80-х годов научился очень быстро замораживать воду, чтобы она создавала вокруг образца пленку и тот сохранял бы свою форму в вакууме. В итоге, был создан т.н. «витрифицированный лед Дюбоше», который не рассеивает электроны. Наблюдатель видит молекулы, которые заморожены в этом льду, но сам лед остается «невидимым» для микроскопа.
Дюбоше и стал одним из нобелевских лауреатов этого года. Второй – Ричард Хендерсон – в 1990 году сумел первым получить с помощью электронного микроскопа трехмерное изображение белка родопсина в разрешении до отдельных атомов.
Третий – Йоахим Франк – занимался рибосомами. Рибосома не имеет никакой симметрии. Поэтому собрать ее целостный «портрет» из отдельных изображений молекул долго не получалось. Франк разработал способ компьютерной обработки множества двумерных изображений для получения трехмерной структуры и в итоге создал модель поверхности рибосомы.
 А все вместе лауреаты считаются теперь основателями нового направления – криоэлектронной микроскопии.
А все вместе лауреаты считаются теперь основателями нового направления – криоэлектронной микроскопии.
Какие же новые возможности она открывает? На пресс-конференции в президиуме СО РАН руководитель группы микроскопических исследований Института химической биологии и фундаментальной медицины СО РАН д.б.н. Елена Рябчикова привела пару примеров:
– Возьмем, например, вирус гриппа. В обычном просвечивающем электронном микроскопе мы наблюдаем сам вирус и можем различить шипики на его поверхности, они выглядят «лохматыми». Криоэлектронная микроскопия дает информацию не только о наличии шипиков, но и позволяет оценить их расположение относительно вирусной оболочки. В случае вируса гриппа это очень важно, ведь шипики — это те самые гемагглютинин и нейраминидаза, которые определяют типы вируса. Или, допустим, криосрез эпидермиса кожи: с его помощью выясняется, что между границами двух клеток есть липидные многослойные структуры.
Никакой другой метод не покажет и тоненькие «волоски» на поверхности супермелкой бактерии, а ведь с помощью таких «органов» бактериальные клетки взаимодействуют с клетками людей и животных, в результате чего мы можем заболеть. Конечно, однако, после этого надо поставить запятую и перечислить еще около сотни полезных вещей, которые криоэлектронная микроскопия может дать.
Разговор о возможностях современной микроскопии и о том, как высоко оценивает значение этой отрасли научное сообщество, мы продолжили с заведующим Центром коллективного пользования микроскопического анализа биологических объектов (Институт цитологии и генетики СО РАН) к.б.н. Сергеем Байбородиным.
– Сергей Иванович, скажите, насколько вообще часто достижения в области микроскопии удостаиваются Нобелевской премии?
– На самом деле не так уж и часто. В 1986 году Нобелевскую премию по физике присудили Эрнсту Руска, который построил первый прототип просвечивающего электронного микроскопа (причем, он сделал это еще в 1932 году). Вместе с ним премию получили изобретатели сканирующего зондового микроскопа Герд Карл Бинниг и Генрих Рорер. И, действительно, появление электронной микроскопии стало настоящим прорывом в науке, в области научной приборной базы. Ранее, в 1953 году, голландский ученый Фриц Цернике получил Нобелевскую премию по физике за изобретение фазово-контрастной микроскопии. Это метод получения изображения в оптической микроскопии, позволяющий изучать неокрашенные препараты, разделяя их структуру по оптической плотности. Если брать несколько шире, то можно привести еще пару примеров, когда премия вручалась за исследования, тесно завязанные на микроскопию. В самом начале века, в 1906 году, химик Камилло Гольджи был удостоен Нобелевской премии по физиологии и медицине за изучение клеток нервной системы. В частности, величайшей работой Гольджи многие считают революционный метод окрашивания отдельных нервов и клеток, названный «чёрной реакцией». И в 1974 году два бельгийца - Альбер Клод и Кристиан де Дюв - вместе с американцем Джорджем Паладе получили Нобелевскую премию по физиологии и медицине за открытия, касающиеся структурной и функциональной организации клетки. Это был цикл работ, выполненных с помощью электронной и световой микроскопии, разных ее методов. Вот, пожалуй, и все.
– А теперь Нобелевской премии удостоена криоэлектронная микроскопия. Насколько важен этот метод?
 – Я не готов оценить значение криоэлектронной микроскопии в отдельности. Сейчас все идет настолько в комплексе – и физические, и химические, и рентгеновские исследования. И часть этого общего процесса – упомянутый метод. А чтобы давать ему отдельную оценку, я не настолько хорошо с ним знаком.
– Я не готов оценить значение криоэлектронной микроскопии в отдельности. Сейчас все идет настолько в комплексе – и физические, и химические, и рентгеновские исследования. И часть этого общего процесса – упомянутый метод. А чтобы давать ему отдельную оценку, я не настолько хорошо с ним знаком.
– Тогда поговорим о задачах развития микроскопии в целом. Ученые разглядели клетку, потом отдельные молекулы, теперь на очереди атом?
– На самом деле, микроскопы, способные различать атомы, уже есть. Вопрос не столько в масштабах, сколько в качестве изображения и том объеме информации, которую можно из него извлечь. И здесь микроскопия не стоит на месте, идет постоянное развитие, в том числе, благодаря комплексному подходу, о котором я говорил. Да, «заглянуть внутрь» живой, функционирующей клетки и получить объемную картинку происходящих в ней процессов мы в обозримом будущем вряд ли сможем. Но наука научилась, в определенной степени, обходить этот барьер: когда путем объединения полученных изображений ультратонких срезов с клетки для электронной микроскопии или оптических срезов для конфокальной лазерной микроскопии мы создаем ее трехмерную модель и таким образом можем изучать работу клетки «изнутри». И этот подход сейчас активно развивается.
– Современное микроскопическое оборудование стоит очень дорого. Насколько хорошо им обеспечены институты Академгородка?
– На самом деле, в институтах СО РАН есть современные трансмиссионные и сканирующие электронные микроскопы – у физиков, геологов, химиков. Что касается микроскопии для биологических исследований, то наш Центр коллективного пользования обеспечен приборами хорошо. У нас есть трансмиссионные электронные микроскопы, установлен сканирующий лазерный микроскоп, причем в такой полной комплектации он, пожалуй, единственный в России. И на сегодня его возможности еще полностью даже не используются – далеко не у всех научных групп есть средства и финансирование для экспериментов столь высокой степени сложности. Есть хорошие флюоресцентные микроскопы с соответствующим программным обеспечением для обработки полученных изображений.
То есть, оснащение нашего ЦКП немного опережает текущие запросы научных сотрудников СО РАН, а значит – есть простор для развития соответствующей исследовательской работы.
Есть хорошие сканирующие лазерные микроскопы в ряде биологических и медицинских институтов. Но, опять же, по ряду задач они обращаются в наш ЦКП. И дело тут даже не в разнице в оборудовании. Просто подготовить и провести современный сложный эксперимент нельзя без специалиста с соответствующей подготовкой. И поскольку определенные задачи возникают в этих институтах не так часто, им проще и удобнее обратиться к нам, чем заниматься подготовкой собственных специалистов такого профиля. С ходу такую технику не освоишь. Мы им оказываем необходимую помощь, поскольку у нас, повторю, есть для этого все необходимое. А возможности нашего оборудования пока даже шире тех задач, которые ставят перед собой исследователи.
Наталья Тимакова
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии