Не так давно в ФИЦ «Институт цитологии и генетики СО РАН» был представлен цикл презентаций «Как создаются современные лекарства». Поводом для выбора темы стали новые возможности, которые дало объединение «под крышей» одного Федерального исследовательского центра ведущего института СО РАН, занимающегося фундаментальными генетическими исследованиями, и двух НИИ медицинского профиля. Теперь в рамках одной организации стало возможным осуществление полного цикла создания лекарственного препарата, от компьютерных моделей до клинических испытаний и выпуска пробных партий готового препарата. О чем собственно и рассказали собравшимся (журналистам и студентам вузов Новосибирска) сотрудники ФИЦ ИЦиГ.
Сегодня путь на рынок для любого нового лекарства занимает много лет, а начинается он в научных лабораториях, где часто вместе работают молекулярные генетики и специалисты по биоинформатике.
Об этом этапе рассказала сотрудник лаборатории компьютерной протеомики Института цитологии и генетики Олька Сайк. А точнее – про поиск потенциальных генов-мишеней, перспективных для разработки новых лекарств с помощью анализа генных сетей.
В настоящее время медицине известно более 10 тысяч различных заболеваний и синдромов, от которых может страдать человек. В Госреестре зарегистрировано почти 40 тысяч лекарственных препаратов. И, тем не менее, для многих заболеваний существует только симптоматическое лечение (не устраняющее саму болезнь, а лишь ослабляющее ее воздействие), а уровень смертности населения остается высоким.
Не упрощают жизнь медикам и другие факторы: с годами многие бактерии и вирусы становятся устойчивыми к существующим лекарствам, сильнодействующие препараты имеют неприятные побочные свойства, а одновременный прием разных лекарств (при одновременном лечении разных болезней) может вести к новым осложнениям.
В этой ситуации требуются новые лекарства, более эффективные и в то же время безопасные, а еще лучше – персонализированные, учитывающие генетические особенности пациента. Ключевым этапом при их создании является правильный выбор фармакологической мишени, выбор белка, на который необходимо оказать химическое воздействие для предотвращения развития заболевания.
Сделать этот поиск более быстрым, эффективным и менее затратным позволяют методы биоинформатики, опирающиеся на анализ генных сетей.
– В начале прошлого века генетика исходила из парадигмы, что один ген определяет один фенотипический признак, - напомнила Ольга Сайк. – Но позднее ученые пришли к выводу, что отдельный признак обеспечивается функционированием группы взаимодействующих генов. К примеру, цвет глаз определяется группой из 5-10 генов. Так и возникла концепция генных сетей, каждая из которых определяет тот или иной признак организма. А сам ген при этом может быть включен в разные сети.
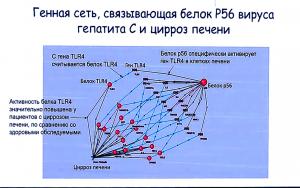 Анализ генных сетей, в частности, позволяет понять, каким образом воздействие вируса или мутации самого гена может приводить к развитию определенного заболевания. В качестве примера Ольга Сайк привела модель воздействия вируса гепатита С, ведущего к развитию цирроза печени. Известно, что белок вируса р56 может специфически активировать белок TLR4 в клетках печени человека. Также известно, что у людей, болеющих циррозом, уровень данного белка в печени значительно повышен. Далее, выстроив модель генной сети, в которой задействован пораженный вирусом ген, можно выделить гены-мишени, воздействие на которые позволит нейтрализовать негативный фактор.
Анализ генных сетей, в частности, позволяет понять, каким образом воздействие вируса или мутации самого гена может приводить к развитию определенного заболевания. В качестве примера Ольга Сайк привела модель воздействия вируса гепатита С, ведущего к развитию цирроза печени. Известно, что белок вируса р56 может специфически активировать белок TLR4 в клетках печени человека. Также известно, что у людей, болеющих циррозом, уровень данного белка в печени значительно повышен. Далее, выстроив модель генной сети, в которой задействован пораженный вирусом ген, можно выделить гены-мишени, воздействие на которые позволит нейтрализовать негативный фактор.
Один из подходов предполагает выделение внутри сети отдельных кластеров, ответственных за те или иные процессы, затем выбирают те из них, что наиболее вовлечены в процесс развития заболевания (апоптоз клеток или наоборот – иммунный ответ и т.п.), после чего работают, в первую очередь, с ними. Затем внутри кластера ищут хабы (центральные вершины) – гены, через которые проходит больше всего связей внутри генной сети. Обычно это белки – регуляторные молекулы. Именно они и являются приоритетными генами-мишенями.
Дальнейший анализ позволяет также оценить риски развития у пациента побочного эффекта в результате воздействия на мишень лекарством. Ведь ген, выбранный мишенью, может участвовать во многих других процессах, в том числе, не связанных напрямую с заболеванием. И надо оценить, как это воздействие повлияет на другие процессы, в которые вовлечен ген. Исходя из этого, приоритет получают гены, которые имею меньше связей с иными биологическими процессами.
Звучит довольно просто, но на самом деле решение этой задачи занимает массу времени и сил. Ведь многие сети включают сотни генов и еще больше – регуляторных взаимодействий между ними. Для проведения всего этого объемного анализа разработан специальный математически аппарат. Изучая воздействие того же вируса гепатита С, сотрудники ИЦиГ выявили 900 белков человека, вовлеченных в этот процесс. А затем, проанализировав их работу в генных сетях, определили несколько потенциальных кандидатов в гены-мишени, причем, не только для лечения собственно гепатита С. Так, белок человека енолаза 1 (ENO1) может быть также мишенью для лекарств против воспаления легких, неходжкинской лимфомы и глиомы. И все же – это только первый (и не самый трудоемкий) этап на пути к новому лекарственному препарату.
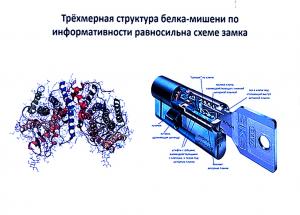 Следующий шаг – компьютерное моделирование потенциальных ингибиторов: сначала строится модель белка-мишени, а затем подбирается химическое соединение, которое блокировало бы его работу. Более подробно об этой работе рассказал еще один сотрудник лаборатории компьютерной протеомики Никита Иванисенко.
Следующий шаг – компьютерное моделирование потенциальных ингибиторов: сначала строится модель белка-мишени, а затем подбирается химическое соединение, которое блокировало бы его работу. Более подробно об этой работе рассказал еще один сотрудник лаборатории компьютерной протеомики Никита Иванисенко.
– Если вы проанализируете, что вам выписывает терапевт, то вы увидите, что большинство лекарств – это низкомолекулярные соединения, - сказал он. – Фактически, задача молекулы лекарства – ингибировать конкретный белок (затормаживать или останавливать его работу), который ответственен за возникновение и развитие заболевания.
К примеру, установлено, что если удастся проингибировать (нарушить работу) белка протеаза ВИЧ-1, то сам вирус иммунодефицита человека также прекращает размножаться и поражать организм. Собственно, сегодня множество исследований по созданию лекарства против ВИЧ работают именно в этом направлении.
В описании такого рода исследований, ученые часто используют аналогию «ключ-замок». В ней белку отводится роль «ящика», который надо «открыть». «Замочной скважиной» в данном случае является некий сайт (место, через которое к нему может прикрепиться молекула лекарственного препарата).
И задачей ученых на данном этапе является смоделировать химическое соединение, которое смогло бы связаться с этим сайтом, создать «ключ» для этого уникального природного «замка».
Существует много способов подбора таких соединений, которые в фармацевтике классифицируют по двум подтипам. Это методы полного перебора (когда проверяются все возможные комбинации, а речь может идти о миллионах вариантов) и методы рационального подхода (когда сначала изучается устройство «замка», и на основе этого подбираются подобия «ключей»). Оба подхода сегодня широко используются в фармацевтике. Первый подход более понятен и методы поиска в его рамках хорошо отработаны, зато второй часто помогает значительно сэкономить ресурсы и время.
Каким же образом ученые изучают «замки» белков. Большой популярностью пользуется, в частности, метод рентгеноструктурного анализа. Для начала надо вырастить кристалл, который будет состоять из белка-мишени (что само по себе очень непростая задача). Затем проводится анализ дифракции рентгеновских лучей. И на его основе строится компьютерная модель белка-мишени, которая и предоставляет информацию об устройстве его «замка». Правда, в этой модели нет информации о том, какие части молекулы белка подвижны, а какие – нет. На этом этапе и начинается рациональный поиск «отмычки», с использованием компьютерных вычислений, таких как машинное обучение.
Как видно из описания, несмотря на то, что такой подход заметно сокращает число кандидатов на роль «отмычки», сам по себе он подразумевает решение сложных задач и привлечение для этого весьма компетентных специалистов. Поэтому, несмотря на очевидные «слабые места», методы полного перебора по-прежнему пользуются высокой популярностью у фармацевтических компаний.
Впрочем, формирование некоего списка кандидатов на роль нового лекарства – это лишь первый шаг. Далее в работу включаются исследователи другого профиля, о которых мы подробнее расскажем в следующих частях нашего мини-цикла.
Наталья Тимакова
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

