В многочисленном царстве вирусов есть совершенно выдающийся представитель — вирус осповакцины, входящий в семейство ортопоксвирусов. Он сыграл главную роль в избавлении человечества от оспы, с древнейших времен уносившей миллионы жизней. Сейчас эта болезнь побеждена на всем земном шаре, в том числе благодаря нашему герою. Но «на покой» ему явно рано: ученые возлагают на него большие надежды в области лечения онкологических заболеваний.
Анастасия Юрьевна Юнусова, аспирантка Института химической биологии и фундаментальной медицины СО РАН (группа микроскопических исследований) рассказывает:
— Исследования инфекционных агентов, способных бороться с раком, наша лаборатория проводит совместно с коллегами из ГНЦ ВБ «Вектор».
Онколитические вирусы — это совокупность разных вирусов, которые не патогенны для человека, для нормальных тканей в его организме, но они размножаются и вызывают гибель быстроделящихся опухолевых клеток.
В связи с этой их специфичностью — способностью размножаться в опухолевых клетках — довольно давно появилась идея о том, что их можно применять в терапии онкологических заболеваний. Когда были открыты онколитические способности инфекционных агентов (впервые — у одного из аденовирусов), исследователи стали изучать множество других вирусов и обнаружили, что существует целая панель подобных объектов.
— Я занимаюсь вирусом осповакцины, — продолжает Анастасия Юнусова. — Чем он хорош? В свое время, когда была программа по ликвидации оспы, именно вирус осповакцины применяли для вакцинации. Соответственно, сейчас хорошо известно, как этот агент себя ведет в организме человека, и есть массив знаний, который позволит ликвидировать побочные эффекты от терапии, если они возникнут. Кроме того, у него есть природная способность: «охотнее» размножаться именно в опухолевых клетках. Базовый эксперимент показывает: если взять разные клетки — культуру нормальных и панель раковых — и добавить суспензию вируса, то он активнее будет размножаться именно в опухолевых клетках. Почему существует такая селективность — сейчас исследуется, до конца механизм этого очень важного феномена ученым пока неизвестен.
Важным условием исследований является то, что ученым нужен именно живой вирус, но исходный штамм, как он есть, для терапии не годится, он должен быть ослаблен, чего добиваются методами молекулярной биологии за счет делеции (то есть удаления) из генома вируса некоторых генов. Во-первых, это уменьшает вероятность того, что агент будет размножаться и в нормальных клетках. Во-вторых, увеличивается его специфичность к опухолевым клеткам.
― Например, один из рекомбинантов, которые мы используем в исследовании, это вирус осповакцины, у которого нет гена, отвечающего за производство тимидинкиназы (фермента, играющего ключевую роль в синтезе ДНК), — отмечает Анастасия. — Этот фермент необходим при репликации вируса в момент, когда происходит удвоение ДНК. Вирус осповакцины — самодостаточный, он очень сложно устроен, у него есть свои белки, в том числе тимидинкиназа. Соответственно, если у вируса есть этот ген, при попадании в клетку он не зависит от белков, которые в ней содержатся. Когда же своей тимидинкиназы у вируса нет, при репликации он использует клеточный белок. Поскольку опухолевые клетки быстро делятся, у них в цитоплазме этот фермент всегда в избытке, а в нормальных он появляется циклично. Соответственно, когда у вируса удаляют ген, кодирующий этот фермент, естественно, предпочтительнее он будет размножаться в опухолевых клетках. Размножение вируса в клетке приводит к ее разрушению, таким образом опухолевая клетка погибает.
Помимо ослабления патогенных свойств вируса за счет удаления генов, можно, напротив, вставлять определенные гены в геном вируса, чтобы он, пока реплицируется, экспрессировал молекулы, влияющие на опухолевые клетки. Например, есть ряд белков, которые в клетке запускают апоптоз (клеточное «самоубийство»).
Считается, что этот процесс — наиболее предпочтительный для использования в терапии путь гибели клетки, поскольку при этом не развивается воспалительный процесс. Суть апоптоза в том, что в клетке запускается каскад реакций, в результате чего активируются ферменты, которые специфически начинают разрушать ДНК и белки в клетке.
С точки зрения морфологии в клетках уплотняется ядро, клетка фрагментируется, то есть разрушается, но все ее компоненты остаются заключенными в мембраны. Содержимое цитоплазмы не выходит наружу — обычно именно это вызывает воспалительную реакцию — а в случае апоптоза клеточные «останки» плотно упакованы. Эти апоптотические тельца затем поглощаются либо соседними клетками, либо макрофагами. Получается «чистая» уборка ткани.
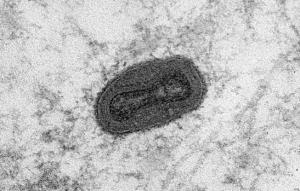 Поскольку современные технологии позволяют это осуществлять, появилась идея генетически модифицировать вирус таким образом, чтобы в его геноме содержался ген белка, запускающего апоптоз. Вирус после проникновения в цитоплазму будет реплицироваться, при этом в цитоплазме клетки будет синтезироваться белок, запускающий апоптоз. И, помимо размножающегося вируса, в клетке еще будет действовать белок, который индуцирует апоптоз и вызывает гибель опухолевой клетки.
Поскольку современные технологии позволяют это осуществлять, появилась идея генетически модифицировать вирус таким образом, чтобы в его геноме содержался ген белка, запускающего апоптоз. Вирус после проникновения в цитоплазму будет реплицироваться, при этом в цитоплазме клетки будет синтезироваться белок, запускающий апоптоз. И, помимо размножающегося вируса, в клетке еще будет действовать белок, который индуцирует апоптоз и вызывает гибель опухолевой клетки.
— Белок, экспрессируемый вирусом осповакцины в наших исследованиях, называется апоптин, — рассказывает Анастасия Юнусова. — Многие исследования подтверждают его способность запускать апоптоз в опухолевых клетках, известен механизм его действия. Эффект вируса, продуцирующего апоптин, мы изучали на мышах, которым прививали опухоль человека, и убедились: вирус, экспрессирующий апоптин, по сравнению с тем, что таким свойством не обладает, но тоже оказывает онколитическое действие, предпочтителен, поскольку приводит к деструкции опухолевых клеток и к «усыханию» опухоли.
Интересно, что данный эффект оказался не связан с апоптозом опухолевых клеток. Объяснение этому явлению было найдено с помощью электронной микроскопии и иммуногистохимии (выявление белков в клетках на микроскопическом уровне). Белок апоптин, чтобы запустить апоптоз, в определенный момент должен оказаться в ядре.
― Наше исследование же показало, что апоптин в ядро не проникал, оставаясь в цитоплазме, — поясняет Анастасия. — Наблюдался феномен: опухоль уменьшается, клетки гибнут, а апоптоз не происходит. Мы долго думали, чем это объясняется: судя по наблюдениям, репродукция вируса в клетке опережает действие белка апоптина, и клетки гибнут от размножения инфекционного агента, апоптин «не успевает» запустить процесс апоптоза. Однако апоптин, находясь в цитоплазме, модифицирует гибель клетки таким образом, что она, грубо говоря, мумифицируется. По всей видимости, белок связывается с компонентами цитоскелета, в частости, с филаментами (внутриклеточными цитоплазматическими фибриллярными белковыми структурами), и в электронный микроскоп мы наблюдали, что да, клетка погибла, но цитоплазма внутри нее заполнена филаментами и представляет собой своеобразную «мумию». То есть апоптоз не происходил, но развивался такой вариант гибели клетки, при котором нет воспаления и отека.
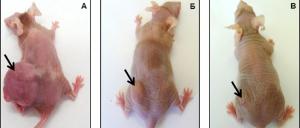 — Для сравнения у нас было две группы, — объясняет исследовательница. — В первой мышей, которым была привита человеческая опухоль, лечили с помощью нерекомбинантного вируса, а во второй — вирусом, экспрессирующим апоптин. У первых подопытных зверьков опухоли разрушались, причем очень быстрыми темпами, но оставался клеточный детрит на месте злокачественного новообразования, наблюдались следы отека и полости, заполненные жидкостью. У вторых грызунов таких эффектов не было, опухоль «усыхала». С помощью контрольной группы, в которой мышкам с привитой опухолью вместо вирусной суспензии вводили физиологический раствор, мы наблюдали динамику размеров: в течение эксперимента опухоль значительно увеличивалась, тогда как у экспериментальных групп грызунов размер опухоли был существенно меньше. На 55-й день у мышей, которым вводили рекомбинантный вирус, опухоль практически исчезала, на ее месте оставался небольшой шрамик. В сравнении с опухолевыми узлами у мышей контрольной группы этот результат — существенный и многообещающий.
— Для сравнения у нас было две группы, — объясняет исследовательница. — В первой мышей, которым была привита человеческая опухоль, лечили с помощью нерекомбинантного вируса, а во второй — вирусом, экспрессирующим апоптин. У первых подопытных зверьков опухоли разрушались, причем очень быстрыми темпами, но оставался клеточный детрит на месте злокачественного новообразования, наблюдались следы отека и полости, заполненные жидкостью. У вторых грызунов таких эффектов не было, опухоль «усыхала». С помощью контрольной группы, в которой мышкам с привитой опухолью вместо вирусной суспензии вводили физиологический раствор, мы наблюдали динамику размеров: в течение эксперимента опухоль значительно увеличивалась, тогда как у экспериментальных групп грызунов размер опухоли был существенно меньше. На 55-й день у мышей, которым вводили рекомбинантный вирус, опухоль практически исчезала, на ее месте оставался небольшой шрамик. В сравнении с опухолевыми узлами у мышей контрольной группы этот результат — существенный и многообещающий.
Несмотря на впечатляющие итоги эксперимента, переходить к доклиническим испытаниям исследователи планируют лишь после того, как до конца разберутся во всех механизмах действия вируса, экспрессирующего апоптин.
— В наших экспериментах используются специальные мышки — «нюды», у которых подавлен иммунитет, что и позволяет привить им под кожу опухоль человека, — поясняет Анастасия Юнусова. — Соответственно, это очень приближенная модель. У подопытных зверьков злокачественное новообразование удобно наблюдать, пальпировать и вводить в него препарат. Лечение заключается в том, что мы доставляем лекарство непосредственно в опухоль и анализируем его действие. Для того, чтобы в дальнейшем можно было перейти к клиническим и доклиническим испытаниям, нужно проделать еще очень много экспериментов: вводить препарат парентерально (минуя ЖКТ, через кожу, мышцы, кровеносные сосуды и т.д.), нужно использовать экспериментальных животных с «нормальным» иммунитетом и разными вариантами опухолей, чтобы посмотреть, как реагирует иммунная система на введение препарата и разрушение новообразования. То есть нам предстоят еще очень длительные исследования.
Исследования онколитических вирусов ведутся в различных странах, в США проходят клинические испытания ряда препаратов (ригвир и реолизин) на их основе. В настоящее время очевидно, что разные вирусы «предпочитают» разные виды опухолей, что говорит о невозможности создать универсальный вирус, который лечил бы все раковые болезни. Скорее всего, в будущем появится некий набор препаратов на основе различных вирусов, «специализирующихся» на определенных видах злокачественных новообразований, который может стать эффективным инструментом для врачей-онкологов.
Елена Трухина
Фото предоставлены Анастасией Юнусовой
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

