На протяжении двух десятилетий (1950 – 1960-е годы) наука значительно продвинулась в понимании того, как работает ДНК и осуществляется регуляция генов (об этом говорилось в первой части). Но серьезной проблемой для дальнейшей работы с этой молекулой были ее огромные размеры. К тому же на тот период у исследователей просто не было технологий, позволяющих «вырезать» отдельный ген и работать с ним по отдельности.
Ситуация кардинально изменилась, когда была создана технология рекомбинантной ДНК. Ее, пожалуй, можно считать первой генетической технологией, получившей широкое распространение. Заработала она благодаря открытию фермента – лигазы – который позволяет склеивать концевые участки молекул ДНК, а также группы ферментов, расщепляющих ДНК - рестриктазы.
Последние обнаружил швейцарский биохимик Вернер Арбер, когда изучал, как клетки защищаются от атак вирусов. Оказалось, в бактериальных клетках есть фермент (рестриктаза), который подавляет размножение вирусов, разрезая на фрагменты чужеродную ДНК. Причем, он делает это, лишь если обнаружит в ней конкретную последовательность, характерную для вируса.
Арбер заинтересовался, почему же не страдает собственная ДНК бактерии в местах, где встречается такая же последовательность. И выяснил, что бактерия одновременно синтезирует фермент, модифицирующий ее последовательности, которые могли бы привлечь рестриктазу, и тем самым защищает свою ДНК от ее «внимания».
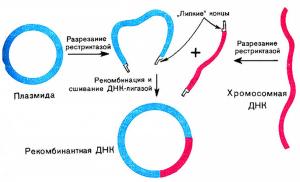 Третьим инструментом стали плазмиды, которые были обнаружены во ходе исследования процессов возникновения у бактерий устойчивости к антибиотикам. Это небольшие молекулы ДНК, находящиеся внутри бактерии, физически отдельные от геномных хромосом. Плазмиды, по сути, были средством горизонтального переноса генетической информации от бактерии к бактерии.
Третьим инструментом стали плазмиды, которые были обнаружены во ходе исследования процессов возникновения у бактерий устойчивости к антибиотикам. Это небольшие молекулы ДНК, находящиеся внутри бактерии, физически отдельные от геномных хромосом. Плазмиды, по сути, были средством горизонтального переноса генетической информации от бактерии к бактерии.
Так генетики получили все необходимые инструменты. Вот как описал этот процесс один из мэтров, Джеймс Уотсон: «Сначала было нужно разрезать молекулу ДНК при помощи рестриктаз и выделить интересующие нас последовательности (гены), а затем скопировать интересующий нас фрагмент ДНК и вставить плазмиду в бактериальную клетку, как USB-флешку в подготовленный для нее разъем. За этим процессом последует обычное бинарное деление бактерий, и плазмида с выбранным нами фрагментом ДНК будет реплицироваться точно так же, как и собственный генетический материал, унаследованный бактериальной клеткой». Впервые на практике это было проделано в 1973 году в Гонолулу на конференции, посвященной исследованию плазмид.
Перехода от бактерий к работе с ДНК земноводных и млекопитающих долго ждать не пришлось. Казалось, перед генетикой открываются ошеломляющие перспективы и вскоре ученые смогут примерить роль Творца. Это было время, когда приток амбициозной и талантливой молодежи в эту область науки заметно вырос. Но тогда же зазвучали и первые опасения – не открывают ли генетические технологии ящик Пандоры с последствиями, которые предугадать невозможно. В этом отношении – сочетание грандиозных перспектив с масштабными опасениями и даже фобиями – ситуация для генетических технологий в наше время не сильно изменилась.
Тогда все вылилось сначала в «Письмо о моратории», призывавшем ученых всего мира добровольно приостановить все исследования рекомбинантной ДНК «до более полной оценки потенциальных угроз». Письмо подписало достаточное число авторитетных исследователей, чтобы к нему прислушались. Но возможности, которые научное сообщество связывало с этой технологией стали причиной того, что два года спустя (в 1975 году) был организован специальный конгресс, на который приехало 140 генетиков со всего мира. Там было выработано более компромиссное решение о том, что допускается продолжать исследования с использованием непатогенных бактерий. Также вменялось в обязанность оборудовать дорогие карантинные комплексы для работы с ДНК млекопитающих, обеспечивающие биологическую безопасность.
 Тогда же генетикам Запада пришлось впервые столкнуться с массовыми общественными кампаниями протеста против их исследований (технологии клонирования, которой по сути была рекомбинантная ДНК). Впрочем, их советские коллеги парой десятилетий ранее оказались в куда худшем положении и в 1970-е изо всех сил старались преодолеть отставание от мировой науки, возникшее в следствие разгула лысенковщины. Потому, кстати, в этих дискуссиях вокруг рекомбинантной ДНК наша наука заметного участия не принимала.
Тогда же генетикам Запада пришлось впервые столкнуться с массовыми общественными кампаниями протеста против их исследований (технологии клонирования, которой по сути была рекомбинантная ДНК). Впрочем, их советские коллеги парой десятилетий ранее оказались в куда худшем положении и в 1970-е изо всех сил старались преодолеть отставание от мировой науки, возникшее в следствие разгула лысенковщины. Потому, кстати, в этих дискуссиях вокруг рекомбинантной ДНК наша наука заметного участия не принимала.
А дискуссия была жаркой: мэр Кембриджа (штат Массачусетс, США) вступил в борьбу с элитными вузами, расположенными в его городе – МТИ и Гарвардом, обвиняя их в «создании монстров». В 1977 году он написал президенту Национальной академии наук (США): «В сегодняшнем номере Boston Herald American (издательская корпорация «Хёрст») есть два репортажа, вызывающих у меня серьезное беспокойство. В Дувре, штат Массачусетс, заметили «странное существо с оранжевыми глазами», а в Холлисе, штат Нью-Гемпшир, мужчина и двое его сыновей повстречали «волосатую девятифутовую тварь»». Это к пониманию, о каком накале страстей идет речь. Ему, кстати, удалось добиться запрета на все работы с рекомбинантной ДНК на территории Кембриджа. Правда, в ряде других научных центров американским генетикам удалось отстоять свое право проводить подобную работу. К слову, толчком для этой многолетней дискуссии стали исследования рака у млекопитающих с помощью этой технологии, которые в 1973 – 1979 годах были фактически заморожены.
Но зато в эти годы была разработана еще одна фундаментальная технология – секвенирования ДНК (это манипулировать с генами требовали с осторожностью, а в расшифровке генетической информации на то время законодательных ограничений не было). В результате, одновременно появилось два варианта этой технологии, одна в Гарварде, другая в британском Кембридже. Вклад в науку британского ученого, работавшего над секвенированием, Фреда Сенгера в 1980 году был оценен Нобелевской премией. Причем, это была уже второй его «Нобель», первую награду он получил еще в 1958 году за изобретение метода секвенирования белков.
Эти технологии достаточно быстро принесли первые прикладные результаты: завершив секвенирование ДНК нескольких хорошо изученных вирусных онкогенов, удалось выявить конкретные гены, вызывающие рак. Вскоре молекулярные биологи начали выделять гены из раковых клеток человека, и затем было найдено подтверждение тому, что рак у человека возникает из-за изменений на уровне ДНК, а не из-за обычных негенетических проблем роста, как предполагалось ранее.
То, что произошло после первых публикаций, эксперты назвали «генетическим кладоискательством». Если в исследованиях до 1970 года, когда была открыта двойная спираль ДНК и наука научилась читать генетический код, было задействовано по всему миру около трехсот исследователей, то десятилетие спустя их число в этой области выросло в сотни раз. А в мировой экономике возникла совершенно новая индустрия – биотехнологии.
«Молекула ДНК вышла из академических кулуаров, населенных людьми в белых халатах, в большой мир, где обитают в основном носители шелковых галстуков и строгих костюмов», - писал все тот же Джеймс Уотсон.
Стало очевидным, что ящик Пандоры открыт бесповоротно и цивилизации предстоит учиться использовать генетические технологии во благо. Учитывая опыт с расщеплением атома, не всегда это будет получаться гладко. И недавняя история с редактированием генома эмбриона в Китае – лучшее тому доказательство. Но, как известно, зубную пасту невозможно запихать обратно в тюбик. А за прошедшие десятилетия эта область знания принесла во много раз больше полезных (и спасительных для многих) результатов, чем сомнительных продуктов. Потому международный День ДНК – праздничная дата в научном сообществе, с чем мы и поздравляем всех, кто так или иначе задействован в генетических исследованиях.
Сергей Исаев
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

