Лаборатория системной биологии старения открылась в НИИ Физико-химической биологии им. Белозерского Московского государственного университета в 2017 году на средства гранта правительства РФ. Руководит ей выпускник МГУ, профессор Гарвардской школы медицины Вадим Гладышев, который рассказал, почему мы стареем, что с этим делать и чем занимаются его коллеги в России и США.
— Существует довольно много концепций старения. Давайте рассмотрим этот процесс сначала на небольшом, на клеточном уровне. Как бы вы определили старую клетку?
— С моей точки зрения, старение — это накопление вредных изменений с возрастом. Это не только молекулярные повреждения, изменения могут быть разными: может быть лишнее либо недостаточное количество какого-то компонента, или клеточный дисбаланс, или еще какие-то изменения. Например, в составе белкового комплекса одного белка больше, чем нужно, а другого — недостаточно. С возрастом такие изменения накапливаются. Это применимо и к клетке, и к организму, потому что большинство одноклеточных организмов так же стареют, как и многоклеточные, нет особой разницы. Но в многоклеточном организме сложнее, потому что в нем стареют разные органы и разные клетки внутри органов, и они как-то между собой взаимодействуют. Разные органы могут стареть с разной скоростью, разные клетки могут стареть с разной скоростью, и они все влияют друг на друга.
— Есть ли какая-то граница, по которой можно отличить старую клетку от нестарой?
— Нет, это такой непрерывный процесс. Старение начинается фактически с оплодотворения. Оплодотворилась яйцеклетка, возник новый организм и тут же начал стареть. Просто среди зародышей высокая смертность, поэтому повреждений еще не видно на фоне всего остального. Это проявляется фактически только после девяти лет, в случае человека, когда начинает расти смертность с возрастом.
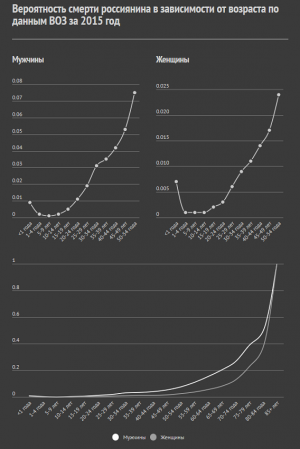 — Можно ли выделить какую-то ключевую причину старения?
— Можно ли выделить какую-то ключевую причину старения?
— В этом-то и проблема. Непонятно, как сделать эксперимент, который отражал бы переход всей системы в старое состояние, а не каких-то ее частей. Обычно берут какую-то часть, например какой-то один ген или органеллу, и смотрят на них, пытаясь понять старение. Но это не может полностью отразить картину старения всего организма.
— То есть мы не можем взять никакой отдельный фактор и назвать его причиной?
— Нет главной причины старения. Ее не может принципиально быть. Представим такую ситуацию: какой-то фактор стал лимитирующим. Вот он — основная причина старения, из-за него все стареет. Тогда можно ожидать, что ослабнет естественный отбор на все другие компоненты. Допустим, что есть какой-то другой белок, который работает очень хорошо, он не ломается и функционирует всю жизнь. И в нем возникла мутация, он стал из-за этого чуть-чуть хуже. Но это будет неважно, он не отсеется отбором, потому что другая причина старения все равно лимитирующая. Потом в другом гене возникла мутация, в третьем… Все постепенно станет хуже и хуже, пока не синхронизируется с тем фактором, который у нас вначале был основной. В результате опять много факторов будут действовать вместе на старение, и не будет одного основного. Но синхронизация будет не абсолютная, и это проявляется по-разному у разных видов. Мыши, особенно лабораторные, часто умирают от определенных видов рака, а человек — от болезней сердца. Это происходит, потому что синхронизация процессов угасания не абсолютная, есть разная предрасположенность для возраст-зависимых болезней.
— Насколько однозначно связано старение клеток и старение организма? Предположим, у нас есть голый землекоп, который практически не стареет. В то же время вы недавно писали о том, что некоторые механизмы старения у него обнаружены. Значит ли это, что отдельные клетки подвержены старению, а сам землекоп — нет?
— Нет, это не совсем так. Я думаю, что землекоп тоже стареет. Просто он очень долго живет. А поскольку у нас повреждения накапливаются все вместе, трудно найти основную причину. Но иногда можно манипулировать каким-то реперным белком, который влияет на множество других процессов. Допустим, мы его убрали — все поменялось, организм стал другим и теперь он стареет чуть по-другому и может стареть дольше. Вот так и землекоп: он стареет дольше, и так долго стареет, что очень трудно заметить этот процесс.
— Но отдельные стареющие клетки в его организме все-таки накапливаются?
— Конечно. Например, у него есть нейроны. Они формируются во время эмбрионального развития. Потом они не замещаются, они невозобновляемые клетки. Иногда в них что-то случается, например мутация произошла или какая-то другая ошибка, — нейрон умер, а его заместить нельзя никак. Прошло какое-то время — еще один нейрон умирает, другой, третий. Получается, что организм не может не стареть. Это относится к любому млекопитающему.
— Владимир Скулачев с соавторами выдвинул предположение, что землекоп — это неотеническая мышь (то есть такая, у которой развитие сильно замедлено, поэтому особи начинают размножаться еще в детском возрасте — прим. авт.), а человек — это неотеническая обезьяна. Поэтому землекоп стареет медленнее, чем мышь, а мы — медленнее, чем обезьяны. Есть ли у нас какие-то свои механизмы, которые позволяют нам медленнее стареть?
— Это интересный вопрос. У нас проект есть на эту тему в московской лаборатории. Мы как раз пытаемся обнаружить на уровне эволюционных процессов какие-то общие черты между человеком и землекопом по сравнению с их ближайшими родственниками, которые не неотеничны. С ходу гены, отвечающие за эти процессы, не находятся, но мы все еще ищем.
— Есть ли шанс, что мы можем какой-нибудь механизм долголетия позаимствовать у землекопа себе?
— Да, это одна из основных идей в моей лаборатории. Мы хотим изучить долгоживущие организмы, в том числе землекопа, и как-то использовать механизмы, которые возникли у них за время эволюции. Но для людей это не вопрос завтрашнего дня, конечно, потому что сначала надо на мышах проверить.
![Схема сравнительной длительности жизни различных животных. [А] Максимальная длительность жизни, взятая по отношению к массе взрослой особи; [В] Примеры видов-долгожителей; [С] Сравнительное расположение некоторых видов млекопитающих по отношению к средней длительности их жизни Схема сравнительной длительности жизни различных животных. [А] Максимальная длительность жизни, взятая по отношению к массе взрослой особи; [В] Примеры видов-долгожителей; [С] Сравнительное расположение некоторых видов млекопитающих по отношению к средней длительности их жизни](/sites/default/files/styles/inline/public/docs/images/210503.jpg?itok=Ikh2BShh) — Как вам кажется, у какой из стратегий продления жизни больше шансов в ближайшее время?
— Как вам кажется, у какой из стратегий продления жизни больше шансов в ближайшее время?
— Одна тенденция — это простые интервенции, такие как ограничение калорий, они уже есть, их можно проверять. Привлечение механизмов от долгоживущих организмов — это вторая, более долгосрочная тенденция, с потенциалом на более радикальное изменение продолжительности жизни. Обычные простые интервенции на мышах продлевают жизнь на 20-30% максимум. Если перенести на человека — а у него скорее всего [подобные интервенции] не будут так хорошо работать — это увеличение [длительности жизни] на 10 или 20 лет, в идеале. И есть еще третий вариант — он совсем новый, вышла только одна статья на эту тему, здесь пока мало данных — это омоложение in vivo, внутри организма, когда можно экспрессировать так называемые «факторы Яманаки». Это четыре фактора транскрипции, которые позволяют перевести клетку из взрослого состояния в эмбриональное (материал «Чердака» на эту тему — прим авт.). Вышла год назад эта работа. Там ученые экспрессировали эти четыре гена у мыши, часть клеток перешла в более молодое состояние, и мышь стала жить дольше. Но тут проблема такая: когда мы клетку омолаживаем, мы сильно увеличиваем вероятность рака. Поэтому в той работе они немного схитрили, что ли: они сделали эксперимент на короткоживущей линии мышей, у которых не успел рак возникнуть. Но принципиально это очень хорошая идея. Можно одновременно и омолаживать, и бороться против рака, объединить эти стратегии. У этого направления есть большой потенциал. Я слышал от нескольких лабораторий, что сейчас активно идут исследования на эту тему.
— Но в таком случае у нас может возникнуть проблема, что мы медленнее учимся бороться с раком, чем репрограммировать клетки.
— Почему же, в случае рака — тоже очень большой прогресс за последние годы. Раки сейчас секвенируют, для каждого типа рака нашли основные драйверы, и под эти драйверы подбираются ингибиторы. Раньше лечили просто: химиотерапия или радио — и привет, для всех одинаково. А сейчас берут рак, секвенируют и знают уже, какой взять ингибитор, который действует именно на тот ген, который смутировал. Это совершенно другой уровень.
Полина Лосева
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

