Наш цикл основан на серии лекций, прочитанных сотрудниками ФИЦ "Институт цитологии и генетики СО РАН" журналистам и студентам вузов Новосибирска. Ранее мы рассказали, как с помощью биоинформатики происходит поиск потенциальных «мишеней» для фармакологического воздействия, а также синтез новых молекул. Во второй части – об испытаниях in vitro (когда опыты проводятся «в пробирке» — на клеточных культурах) и возможностях индуцированных стволовых клеток.
Но никакие современные научные достижения не отменяют необходимость тщательной проверки любого препарата на живых организмах, сначала на лабораторных животных, а затем - на пациентах-добровольцах. Об этом сегодня и поговорим.
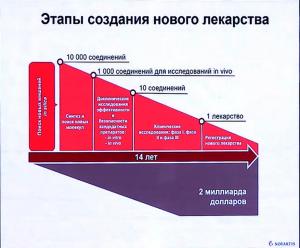
Начнем с вопроса – а сколько денег и времени сегодня уходит на создание нового лекарственного препарата (мы говорим именно о новом, а не о «переиздании» ранее существующего под новой торговой маркой с минимальными изменениями состава).
И удовольствие это не из дешевых: сам процесс занимает 10-15 лет и стоит от полутора до двух миллиардов долларов. Причем, всегда есть риск, что на одной из завершающих стадий процесса будут обнаружены свойства, которые сделают невозможным вывод лекарства на рынок (такое периодически происходит). Да и сама регистрация лекарства не всегда гарантирует благополучную «историю продаж». Естественно, что в таких ситуациях потраченные на создание препарата деньги переходят в графу «убытки».
Что, к слову, одна из причин, по которой многие современные лекарства стоят так дорого: в цену заложены как затраты, так и страховки от возможных убытков (хотя и аппетиты фармкомпаний никто не отменял). Но у нас разговор о научной составляющей этого процесса.
Проверка любого лекарства in vivo начинается с доклинических испытаний на лабораторных животных. Этой работе была посвящена лекция руководителя Центра неклинических испытаний (на базе SPF-вивария), д.б.н. Евгения Завьялова.
Наша справка
Виварием называют помещение для содержания и разведения подопытных животных. А аббревиатура «SPF» (Specific Pathogen Free) обозначает, что в виварии содержатся животные, свободные от патогенов – микроорганизмов, способных вызвать какие-либо заболевания. Обеспечивается это не для комфортной жизни мышей, а для чистоты и точности научных исследований, в том числе и имеющих прикладное значение для медицины и фармакологии. Центров доклинических исследований такого уровня в мире очень немного – около двадцати, а в России и вовсе один, расположенный на территории Института цитологии и генетики СО РАН. При этом виварий относится к ЦКП (центрам коллективного пользования), то есть работать с ним может любой институт Сибирского отделения и других научных учреждений страны.
– Главная задача доклинических исследований - определить как эффективность соединения-кандидата в лекарства, так и его безопасность, выявить возможные побочные эффект от его применения, - отметил Евгений Завьялов. – И очевидно, что достичь этих целей, имея только клеточные культуры, невозможно, для чего в качестве тест-систем и подключают живые организмы.
 Современный список лабораторных животных очень широк, от мушек дрозофил и нематод до высших приматов. Но есть в нем и безусловные лидеры по популярности – лабораторные мыши и крысы (которые и являются основными обитателями SPF-вивария). Мыши по ряду параметров - идеальный объект для генетических исследований (в т.ч. они являются оптимальным сочетанием простоты содержания и близости геномов мыши и человека). Поэтому мыши – «лучшие друзья генетиков», а их «вклад» науки отмечен известным памятником у стен ИЦиГ.
Современный список лабораторных животных очень широк, от мушек дрозофил и нематод до высших приматов. Но есть в нем и безусловные лидеры по популярности – лабораторные мыши и крысы (которые и являются основными обитателями SPF-вивария). Мыши по ряду параметров - идеальный объект для генетических исследований (в т.ч. они являются оптимальным сочетанием простоты содержания и близости геномов мыши и человека). Поэтому мыши – «лучшие друзья генетиков», а их «вклад» науки отмечен известным памятником у стен ИЦиГ.
Для проведения испытаний в центрах создают специальные генетические линии мышей, каждая обладает специально направленной мутацией. В результате, у такой мыши развивается заболевание, близкое к человеческому (чего не бывает у их диких сородичей), делая возможным проверку лекарства. Так в ИЦиГ СО РАН появились мыши, которые страдают катарактой, болезнью Альцгеймера, ожирением, депрессией и многими другими проблемами, свойственными современному homo sapiens. Другие линии обладают особенностями, не вызывающими болезни, но также необходимыми для исследовательской работы (особенности окраса, функционирования тех или иных систем организма и т.д.). На сегодня в мире насчитывается свыше 30 тысяч подобных линий, а количество «заготовок» (колоний измененных стволовых клеток, из которых могут быть получены новые линии) в разы больше. Очевидно, что их создание – крайне сложная, филигранная и дорогостоящая работа. И это главная причина, по которой число подобных центров в мире крайне ограничено. Ведущим «законодателем правил» работы с лабораторными животными среди них считается The Jackson Laboratory (США). Среди тех, кто проводил работы на базе этого центра, тридцать нобелевских лауреатов, что ярко характеризует уровень работы самого центра.
Крысы используются намного реже (но все равно занимают уверенное второе место) и в основном – для исследования различных токсических свойств того или иного препарата.
В настоящее время на базе новосибирского SPF-вивария ведутся испытания по более чем десятку направлений. В одних случаях изучают генетические модели заболеваний (иммунодефицит, рак прямой кишки, гипертензия, раннее старение и др.), в других – эффективность химических препаратов и хирургических методов (ишемия мозга, онкологические заболевания, диабет 1-го типа и т.п.). Большая часть исследований длится не один год и, как было сказано выше, вовсе не является финишным этапом.
Самыми длительными по времени и наиболее важными в процессе создания лекарства являются клинические испытания, о которых рассказала зав. консультационным отделением клиники НИИКЭЛ (филиал ФИЦ "ИЦиГ СО РАН"), к.м.н. Юлия Убшаева.
– Несмотря на все развитие методов доклинических испытаний in vivo и in vitro, медицина не может обойтись без клинических исследований, - подчеркнула она. - На разных стадиях это могут быть как здоровые добровольцы, так и пациенты.
 Клинические исследования, при всем многообразии их форм, принято делить на две большие группы – экспериментальные и обсервационные (наблюдательные). Первые бывают рандомизированные (когда есть основная и контрольная группа) и нет. При этом группа контроля может получать как «плацебо», так и другой лекарственный препарат. Обсервационные исследования делятся на аналитические (если есть группа сравнения) и описательные (когда вся работа ведется только с группой пациентов).
Клинические исследования, при всем многообразии их форм, принято делить на две большие группы – экспериментальные и обсервационные (наблюдательные). Первые бывают рандомизированные (когда есть основная и контрольная группа) и нет. При этом группа контроля может получать как «плацебо», так и другой лекарственный препарат. Обсервационные исследования делятся на аналитические (если есть группа сравнения) и описательные (когда вся работа ведется только с группой пациентов).
Также исследования могут быть одноцентровыми (вся работа проводится в одном месте) и многоцентровыми (где задействованы разные исследовательские организации), открытые (когда пациент знает, что именно он принимает) и «слепые» ( когда пациент, а иногда и врач, не знают, что именно – «плацебо» или препарат вводится в организм).
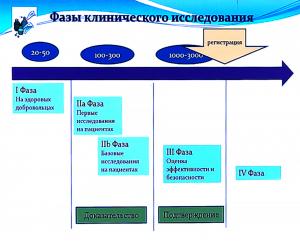
Обычно первая фаза исследований проходит на здоровых добровольцах. Как правило, это небольшая группа лиц (20-100 человек), на которой оцениваются как основные фармацевтические параметры лекарства, так и его безопасность. Этот этап обычно длится около года. В случае успеха начинается апробация на первых пациентах. Здесь речь идет уже о группах в несколько сотен человек. На этой стадии должны быть доказаны безопасность и эффективность лекарства в реальной медицинской практике. И ее продолжительность составляет уже 2-5 лет. А затем успешные результаты должны быть подтверждены третьей фазой клинических испытаний, которая включает прием препарата тремя-пятью тысячами пациентов и длится примерно такое же время, что и вторая. В ее ходе окончательно определяются схемы лечения, дозировка препарата, оцениваются все нежелательные явления. И даже после этого этапа, который в случае положительного результата завершается регистрацией нового лекарства, наблюдения и исследования продолжаются. Известны примеры, когда лекарства запрещались к продаже после нескольких лет применения во врачебной практике (как раз по результатам такого анализа).
Теперь, услышав в новостях о том, что очередной чудо-препарат проходит N-ю фазу испытаний, вы сами сможете прикинуть, сколько времени еще осталось до его появлении на рынке. И то в случае успешности этих испытаний.
Надо отметить, что проведение любых клинических испытаний строго регламентируется рядом протоколов, в т.ч. правилами международного этического и научного стандарта Good Clinical Practice (GCP) и Международного совета по гармонизации (ICH). Первая организация рассматривает этот процесс в основном в рамках отношений «врач-общество», а вторая больше внимания уделяет юридическим аспектам регистрации нового лекарственного средства (в том числе, чтобы убедиться, что сведения, полученные исследователями в одном регионе, применимы и в других частях света). Есть и ряд других важных протоколов. В целом, данные исследования очень детально регламентированы, что и делает появление на рынке лекарств с опасными побочными эффектами единичными инцидентами. Но одновременно – значительно продлевают и удорожают сам исследовательский процесс. Это цена безопасности, которую сначала оплачивают фармкомпании (инвестициями в разработку), а потом и все мы (ценой готовых лекарств).
Наталья Тимакова
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

