Напомним, источником для него послужила серия лекций, прочитанных сотрудниками ФИЦ "Институт цитологии и генетики СО РАН" журналистам и студентам вузов Новосибирска. В первой части рассказывалось, как с помощью биоинформатики происходит моделирование процессов, происходящих в клетке в результате развития того или иного заболевания, и как на основе анализа этих моделей формируются потенциальные «мишени» для фармакологического воздействия. А сегодня поговорим о следующем шаге – испытаниях in vitro (когда опыты проводятся «в пробирке» — вне живого организма).
– После того, как вы «сделали дизайн» лекарственного препарата в компьютере, вам необходимо проверить, как все это работает на практике, и при необходимости доработать этот «дизайн», - с таких слов начал выступление ведущий научный сотрудник сектора геномных механизмов онтогенеза ФИЦ "ИЦиГ СО РАН", к.б.н. Вениамин Фишман.
Итак, после первичного отбора по принципу «ключ-замок» в распоряжении исследователей оказалось несколько десятков вариантов активных веществ и соединений, которые (в соответствии с анализом модели заболевания) могут претендовать на роль лекарства. Далее, начинается проверка этого предположения на практике, которая требует наличия достаточного числа объектов для испытаний (иначе говоря, несколько сотен, а лучше – тысяч «подопытных кроликов»). Вот только где их взять в таком количестве (учитывая, что многие из проверяемых комбинаций могут оказаться на деле не только бесполезными, но и даже токсичными для организма).
Бывает и более сложная ситуация, когда у исследователей вообще нет адекватной модели возникновения и развития заболевания на клеточном уровне. Кстати, весьма распространенный случай.
Чтобы немного упростить тему, докладчик ограничил круг заболеваниями, которые ассоциированы с генами человека. И хотя связь заболеваний с генотипом установлена, во многих случаях остается неясным, как они формируются, что запускает этот механизм и т.п. Соответственно, построить генную сеть (о которой говорилось ранее) невозможно.
 Где же взять материал для исследований? Иногда (особенно – в случае онкологии) таким материалом становится полученный от пациента (например, во время операции) кусочек пораженной ткани. На нем в дальнейшем и проводятся различные эксперименты и т.п. Но этот метод применим с довольно ограниченным классом заболеваний.
Где же взять материал для исследований? Иногда (особенно – в случае онкологии) таким материалом становится полученный от пациента (например, во время операции) кусочек пораженной ткани. На нем в дальнейшем и проводятся различные эксперименты и т.п. Но этот метод применим с довольно ограниченным классом заболеваний.
Другой путь – смоделировать заболевание на лабораторном животном. Но это тоже весьма непросто (приходится выводить специальные генетические линии животных, способные страдать от человеческих недугов) и так же применимо далеко не ко всем заболеваниям.
Взять, к примеру, аутизм – заболевание, которое затрагивает поведение человека, что невозможно изучать на кусочке ткани или лабораторной мыши. Схожие проблемы возникают с депрессией, нейродегенеративными расстройствами и т.д.
– Мы сейчас изучаем заболевание, при котором IQ у пациента останавливается на уровне 50, – рассказал Вениамин Фишман. – Это сильно отличается от нормального уровня для человека, пациент в лучшем случае может сам принимать пищу и ходить в туалет. Но мышь одинаково далека от IQ 50 и IQ 150, мы просто не можем смоделировать на ней такую ситуацию.
«Палочкой-выручалочкой» для ученых стали плюрипотентные (стволовые) клетки, прорыва в изучении которых удалось достичь только в нашем веке. Речь, прежде всего, о работах японского ученого Синъя Яманака: он научился превращать практически любые клеток организма в стволовые клетки. А они уже при дифференцировке способны стать любыми клетками, из которых состоит тело взрослого человека.
В теории все выглядит следующим образом. Сначала из клеток пациента (чаще, клеток кожи) получают плюрипотентные стволовые клетки, их еще называют индуцированными. А затем – дифференцируют их, то есть, получают из них клетки нужного типа, на которых можно проводить любую исследовательскую работу. Причем, число таких объектов определяется скорее нуждами самого исследователя.
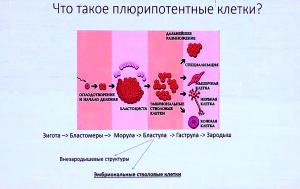 В будущем эту технологию рассматривают как источник необходимых донорских органов и тканей из собственного материала пациента (регенеративная медицина), но пока эта технология до такого уровня не доработана. А вот получать образцы для проведения исследований и испытаний потенциальных лекарств ученые уже научились и вовсю пользуются новым методом.
В будущем эту технологию рассматривают как источник необходимых донорских органов и тканей из собственного материала пациента (регенеративная медицина), но пока эта технология до такого уровня не доработана. А вот получать образцы для проведения исследований и испытаний потенциальных лекарств ученые уже научились и вовсю пользуются новым методом.
Показательный пример – прошлогодние результаты по поиску лекарств от гиперхолестериемии. Это одно из самых распространенных генетических заболеваний проявляется в аномально высоком уровне липидов (до 50 %) в крови пациента. Это ведет к тяжелейшим последствиям, прежде всего, для сердечнососудистой системы и довольно ранней смерти (даже при легких формах заболевания, большинство погибает в возрасте до сорока лет).
Также известно, что возникновение этой болезни во многих случаях вызвано мутацией генов, отвечающих за работу печени по захвату и метаболизму холестерина и других липидов из крови. Собственно, этот сбой в работе печени и является главной проблемой при гиперхолестериемии, в остальном организм пациентов работает нормально, а все иные симптом – вторичные, вызванные высоким уровнем липидов, а не влияющие на него.
– Лекарство, улучшающее работу этих ферментов в печени, искали как раз методом «полного перебора», - продолжил Вениамин Семенович. – Они имели достаточно времени и ресурсов для такой работы. Проблема была в объектах для опытов. Если вы имеете сотни тысяч каких-то соединений, которые вам надо протестировать, вам нужно соответствующее количество биологического материала. В данном случае – больные клетки, в которых данные ферменты неактивны. И на которых можно было бы смотреть: захватывают они липиды после введения очередного претендента на роль лекарства или нет.
Для решения этой задачи исследователи сделали относительно маленькую биопсию кожи нескольким пациентам, страдающим от этого заболевания. Затем – получили из нее плюрипотентные клетки этих людей, из которых после в чашке Петри вырастили клетки печени. Поскольку болезнь имеет генетические корни, клетки изначально были больными, не способными улавливать липиды. И стали, таким образом, отличным материалом для проведения «полного перебора» кандидатов на роль лекарства. Был найден ряд потенциально действенных соединений. И сегодня авторы исследования говорят о готовности приступить к клиническим испытаниям нового лекарства через пару лет.
Подобного рода работы сегодня проводят в лабораториях по всему миру, в том числе и сотрудники ФИЦ "Институт цитологии и генетики СО РАН". Конечно, процесс создания лекарств – дело очень небыстрое и крайне затратное (мы еще коснемся этой темы в третьей части цикла). Но уже сейчас эксперты прогнозируют, что использование индуцированных стволовых клеток на начальных этапах исследований снимет многие барьеры и в ближайшие годы можно ожидать прорыва в лечении многих тяжелых заболеваний.
Конечно, важным моментом является доступность таких лекарств и способность российской промышленности производить их, но это уже, скорее, вопросы экономические и политические. А с научной точки зрения – у нас уже есть (хоть и в очень малом количестве) научные центры, проводящие такие исследования. В том числе, в новосибирском Академгородке.
Наталья Тимакова
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

