Онкология является настоящим вызовом современной науке. Сегодня это чуть ли не единственное заболевание, вызывающее у людей настоящий страх, подобный тому, что сопровождал средневековые эпидемии чумы. И тому есть серьезные основания: ежегодно в мире диагностируют миллионы новых случаев рака и с каждым годом их число только растет. А вот примеров успешного излечения по-прежнему остается крайне мало. Поэтому учёные всего мира продолжают поиск новых методов онкотерапии, шаг за шагом приближаясь к решению задачи. В их числе, сотрудники лаборатории индуцированных клеточных процессов ФИЦ «Институт цитологии и генетики СО РАН». О том, как продвигается их работа и как можно ее ускорить – интервью с руководителем лаборатории, д.б.н. Сергеем Богачевым.
– Сергей Станиславович, насколько известно, Ваша лаборатория не первый год занимается разработкой технологии лечения онкологических заболеваний. Расскажите, каких результатов Вам с коллегами удалось достичь?
– Нами разработана технология, которую мы называем «3+1» или «Каранахан» (в переводе с санскрита – «Убивающий причину»). Речь идет о целенаправленном воздействии на злокачественные стволовые клетки, которые и являются источником возникновения опухоли. И если хоть одна из таких клеток переживает традиционный курс лечения, то она может в любой момент запустить процесс образования новой опухоли. Это, на сегодня, уже признанный мировой наукой факт. Но знать про роль таких клеток недостаточно, надо суметь полностью избавить от них организм, при этом сведя к минимуму вред для здоровых клеток. Что нам и удалось сделать, опробовав нашу технологию уже на нескольких экспериментальных раковых моделях. Частично результаты проделанной работы опубликованы в российской и зарубежной печати, в журналах с достойным импакт-фактором.
– Разве можно создать «оружие избирательного действия» на клеточном уровне?
– Можно, если изучить цель, понять, чем эти клетки отличаются от других. Мы обнаружили, а затем экспериментально подтвердили, что уникальным свойством стволовых клеток различного генеза, включая стволовые инициирующие раковые клетки,(СИРК) является способность захватывать экстраклеточные фрагменты дцДНК естественными природным механизмом. Дальнейшие исследования показали, что, если дать СИРК возможность захватить такие фрагменты через определенный временной промежуток после воздействия цитостатиком циклофосфаном (химиотерапия), то клетка не может завершить процесс восстановления после воздействия ХТ и погибает. Отсюда и второе название нашей технологии: «3+1» (первые три дозы препарата, введенного в опухоль, убивают основную массу стволовых раковых клеток включая и часть СИРК, и синхронизирует оставшиеся СИРК в чувствительной для такой терапии фазе клеточного цикла. Четвертая инъекция, привязанная к времени синхронизации уничтожает оставшиеся СИРК. Лишенная туморогенного начала остаточная опухоль окончательно разрушается иммунной системой).
– Курс лечения занимает много времени?
– Нет, все происходит очень быстро. Во время экспериментов на лабораторных животных весь процесс протекал в течение недели. Мы тогда, кстати, столкнулись с другой проблемой: в организме объекта оказывался большой объем мертвой опухолевой ткани и надо было избежать сепсиса. Но такого рода задачи современная медицина умеет решать вполне эффективно.
 – Вы упомянули про несколько (девять) моделей. Получается Ваша технология обладает достаточно широким спектром действия?
– Вы упомянули про несколько (девять) моделей. Получается Ваша технология обладает достаточно широким спектром действия?
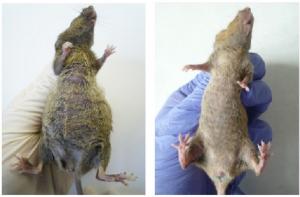
– Мы работали с разными типами онкологии – асцитными и солидными, результаты были положительными. Если режимы подобраны максимально корректно, то опухоль уничтожается навсегда независимо от ее солидного или асцитного варианта. Если режимы, по каким-то причинам не до конца соответствуют биологическим особенностям конкретной опухоли эффект все равно всегда виден и очень отчетливо. В некоторых случаях больше половины мышей конечно излечивалось. В других случаях значительно возрастала продолжительность жизни. Критически важно было соблюдать строгий временной интервал введения препарата, поскольку надо точно поймать то небольшое «временное окно», во время которого стволовые клетки становятся уязвимыми. Наши исследования показали, что этот интервал не только различается у разных видов опухолей, но способен меняться и под воздействием других факторов, например, от времени года: зимой и летом даже у одного типа опухоли этот интервал различается. Так что, оптимальным будет составлять в каждом случае индивидуальный график введения препарата для каждого пациента. С этим связано и единственное технологическое ограничение, с которым на сегодня мы столкнулись – для составления такого графика необходимо предварительно получить образец опухолевой ткани объемом не меньше четырех кубических сантиметров.
– А где-то еще в мире исследования в этом направлении ведутся? Есть у вас потенциальные конкуренты?
– Весной прошлого года в Science была опубликована работа американских ученых во главе с Роном Леви, чьи подходы к лечению экспериментальной опухоли можно назвать в чём-то схожими с нашими. Как и в нашем случае, авторы работы делали инъекции ДНК-препаратов в опухолевый очаг. Одновременно в опухоль вводили специфические анитела. Такая совокупная инъекция активирует систему врожденного иммунитета организма, и она разрушает клетки первичного опухолевого очага до уровня антигенов, после чего антиген-презентирующие дендритные клетки поглощает эти антигены. В результате, в организме формируется адаптивный противораковый иммунитет, вследствие действия которого уничтожаются и очаги опухоли, расположенные на расстоянии от той, в которую вводили инъекции. Но, как выяснилось, эта стратегия применима только к иммунногенным типам опухолей. Для нашей технологии не имеет иммуногенность опухоли – «Каранахан» способен уничтожать любые опухоли и в этом его очевидное преимущество.
– Это преимущество проходило какую-то проверку?
– Да, мы проверили это экспериментально. Поскольку результат американцев был опубликован в Science, их работа вызвала большой интерес. В результате, новосибирским Институтом клинической иммунологии был получен большой грант на исследования в этом направлении, а ИЦиГ в нашем лице выступил в качестве партнера в этом проекте. Мы взяли на себя сравнительную проверку активности нашего и американского подходов.
Вместе моей коллегой Анастасией Лихачевой, решили в одном из экспериментов сравнить американскую технологию с нашей, причем, в одном случае взяли иммуногенную модель опухоли, а в другом – опухоль, не подверженную влиянию иммунитета. В обоих случаях количество мышей было достаточным для статистической обработки. Результаты нас приятно удивили: наша технология оказалась гораздо эффективнее в лечении неиммуногенных опухолей. А они в клинической практике встречаются очень часто.
– Ваши результаты были где-то опубликованы?
 – Наши статьи неоднократно публиковал журнал Oncotarget – издание с высоким импакт-фактором, которое пишет, как раз, о таргетных технологиях лечения. Что касается Science, они готовы рассматривать вопрос о публикации, если мы проведем более широкий анализ клеточных популяций, клеточных маркеров, сделаем еще ряд «технологических реверансов». Все просто потому, что в американском научном сообществе уже сформировалась определенная позиция – что правильными являются только подходы, использующие маркерные антитела, различного рода наборы для выделения специализированных клеток, иммунодифицитных мышей при анализе событий при воздействии на опухоль - и чтобы ее преодолеть нужны значительные дополнительные усилия. Пока у нас банально не хватает бюджета для этого и мы сосредоточились на тех задачах, которые важнее с точки зрения применения технологии в клинической практике. В частности, хотим посмотреть, возможно ли объединить наши подходы, поскольку они очень схожи именно с технологической точки зрения (инъекции набора препаратов в опухолевый очаг). Мы рассчитываем на синергетический эффект, когда одновременно будут уничтожаться злокачественные стволовые клетки и активироваться иммунная система. Теоретическую платформу необходимую для подготовки к слиянию двух технологий мы уже сделали и в ближайшее время хотим проверить наши выкладки экспериментально.
– Наши статьи неоднократно публиковал журнал Oncotarget – издание с высоким импакт-фактором, которое пишет, как раз, о таргетных технологиях лечения. Что касается Science, они готовы рассматривать вопрос о публикации, если мы проведем более широкий анализ клеточных популяций, клеточных маркеров, сделаем еще ряд «технологических реверансов». Все просто потому, что в американском научном сообществе уже сформировалась определенная позиция – что правильными являются только подходы, использующие маркерные антитела, различного рода наборы для выделения специализированных клеток, иммунодифицитных мышей при анализе событий при воздействии на опухоль - и чтобы ее преодолеть нужны значительные дополнительные усилия. Пока у нас банально не хватает бюджета для этого и мы сосредоточились на тех задачах, которые важнее с точки зрения применения технологии в клинической практике. В частности, хотим посмотреть, возможно ли объединить наши подходы, поскольку они очень схожи именно с технологической точки зрения (инъекции набора препаратов в опухолевый очаг). Мы рассчитываем на синергетический эффект, когда одновременно будут уничтожаться злокачественные стволовые клетки и активироваться иммунная система. Теоретическую платформу необходимую для подготовки к слиянию двух технологий мы уже сделали и в ближайшее время хотим проверить наши выкладки экспериментально.
– А дальнейшую проработку своего подхода Вы ведете?
–Для начала мы, по договоренности с главным онкологом Новосибирска Сергеем Васильевичем Сидоровым, получили двадцать операционных образцов опухолевой ткани РМЖ реальных пациентов. Работу с ними вела моя коллега Анастасия Лихачева вместе с молодой, но очень перспективной студенткой Института медицины и психологии НГУ Викторией Купиной (ее нам тоже рекомендовал Сидоров). Задачей было на практике определить, как правильно рассчитать параметры применения технологии «Каранахан», имея образец ткани пациента. Так, кстати, и был вычислен минимальный объем образца, о котором я говорил выше. Стало ясно, что наиболее эффективно технология работает в случаях, когда опухоль достигла больших размеров, то есть мы говорим о четвертой стадии заболевания. Это та самая стадия, перед которой имеющиеся сейчас в распоряжении медицины методы лечения практически бессильны. К своему удивлению мы обнаружили, что в 80 % образцов раковые клетки не делятся. Мы предположили, что рост опухоли идет не постоянно, а периодами: какое-то время клетки активно делятся, потом опухоль «замолкает», а через некоторое время вновь начинает расти. И уязвима опухоль для нашего воздействия только в активной стадии, «замершую» опухоль таким способом не уничтожить. Также мы экспериментально обнаружили, что примерно одна из пяти опухолей в ответ на химиотерапию начинает агрессивно делиться и расти, вместо того, чтобы уменьшаться вследствие гибели своих клеток. В принципе, этот феномен клиницистам уже был известен, когда после химиотерапии опухоль только увеличивалась, мы же получили его объективное доказательство на клеточном уровне. И по итогам экспериментов мы окончательно убедились, что репаративный цикл у каждой опухоли индивидуален, поэтому в каждом отдельном случае технологию лечения надо рассчитывать индивидуально. С этой позиции, «Каранахан» полностью соответствует критериям персонифицированной медицины.
– «Каранахан» пока испытывался исключительно на лабораторных животных и образцах ткани?
– Полноценных клинических испытаний не проводилось, но определенные шаги в этом направлении мы делаем. Когда мы выяснили, что нам нужны для работы опухоли большого размера, Сергей Васильевич сказал, что у него есть подходящая пациентка. Жительница Новосибирска с раком в IV стадии с тремя крупными очагами метастаз. В ее случае врачи признали, что уже ничего не могут сделать. Пациентка дала информированное согласие на использование в лечении нашего метода. У нее во время операции удалили один из очагов метастаз и передали нам, используя его мы рассчитали цикл введения препаратов. А затем, в ходе двух циклов терапии, препараты вводились в оставшиеся очаги пациентки. После первого цикла очаги уменьшились в пять раз, а после второго цикла полностью исчезли, оставив после себя небольшие рубцы. Лечение завершилось в январе, к настоящему времени у пациентки рецидивные явления не проявились. Был еще один случай, когда нашу технологию применили к пациентке с терминальной стадией рака желудка с канцероматозом и множественными метастазами врачи из Казахстана. Там опухоль так же исчезла путем физического отторжения, повергнув врачей в изумление. К сожалению, спустя несколько недель пациентка скончалась из-за сердечно-сосудистой недостаточности. Поскольку смерть наступила через 20 дней после проведенной терапии, мы склонны не связывать трагический исход с проведенным лечением по технологии «Каранахан». Вот такие результаты мы имеем на сегодняшний день. Но надо понимать, что это отдельные случаи и какие-то выводы по ним делать нельзя. Технологии надо пройти полноценный цикл испытаний.
– Только когда это будет, непонятно. Насколько мне известно, с этой проблемой столкнулся не только Ваш коллектив. Часто звучат новости о новых открытиях в области онкотерапии, но куда реже – о их введении в клиническую практику. Что тормозит этот процесс и можно ли его ускорить?
– Я сейчас, конечно, довольно спорную вещь скажу. На мой взгляд, если мы говорим о нашей стране и онкологических заболеваниях, то на мой взгляд нужно при крупном онкологическом центре создать структуру, которая бы позволяла использовать еще не верифицированные разработки на конкретных больных. И обязательно вывести ее из «поля зрения» контролирующих органов любого уровня. И было бы совсем хорошо, если бы ее работу курировала исключительно федеральная власть, причем, оптимально на уровне администрации Президента страны. В структуре должны работать профессиональные врачи. Должен быть этический комитет, отсекающий заведомо неприемлемые подходы и препараты, не подкрепленные большой экспериментальной проработкой. Материалы по каждому препарату или технологии должны находится в информационном поле структуры где любой заинтересованный человек мог прочитать все о препарате или технологии и выбрать для себя вариант лечения. Лечение должно быть абсолютно бесплатным для пациента и обеспечиваться разработчиком. Заработную плату врачей должно обеспечить государство, тем более что врачи будут заняты на своей основной работе, а участие в структуре будет занимать только часть их профессионального времени.
Эта структура должна предоставлять пациентам возможность провести терапию в стационаре. Их кратковременно содержание должно оплачивать государство. Вся информация о применении того или иного подходов должна немедленно появляться в информационном поле структуры. И тогда сразу будет видно, что работает, а что нет и именно сами люди отсекут халтуру.
Естественно, когда мы говорим о потенциальных пациентах, мы имеем в виду людей с терминальной стадией заболевания, к которым применима паллиативная терапия (когда речь идет не об излечении, а уменьшении страданий). Им предлагается возможность добровольно стать пациентами этой структуры, расходы на лечение берут на себя разработчики препарата (или его потенциальные производители), а врачи знают, что их не привлекут к уголовной ответственности за то, что они лечат не по принятым протоколам. То есть, нужна специальная площадка для проведения испытаний, где созданы для этого соответствующие условия. Потому что сегодня один из главных барьеров – это нежелание врачей участвовать в такой работе, они боятся оказаться «крайними», если что-то пойдет не так (а это вполне возможно при испытании любого нового препарата или метода). Конечно, тут надо еще поговаривать массу деталей, в частности, кто и как принимает решение о допуске нового продукта к испытаниям вообще, кто и как на федеральном уровне контролирует работу такой структуры. Но чтобы перейти к такому обсуждению, сначала нужно принять принципиальное решение о создании такой площадки. Или еще какое-то решение, снимающее лишние (не важные с позиций оценки самого объекта проверки) барьеры для проведения испытаний. Пока мы «играем» по старым правилам, прорывных результатов быстро ждать не стоит.
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии