Производство современных лекарств — сложный, долгий и дорогостоящий процесс, в котором задействованы биоинженеры, биотехнологи, химики и биологи. Создание препарата начинается с синтеза новой макромолекулы активного вещества, которое ляжет в основу лекарственного средства. О современной персонализированной медицине и одном из перспективных методов борьбы с раком мы поговорили с Екатериной Авиловой, руководителем направления молекулярных и клеточных исследований GE Healthcare Life Sciences Россия/СНГ, кандидатом биологических наук.
– Понимание того, как ведут себя клетки и молекулы при конкретном заболевании, — это, пожалуй, единственный на сегодняшний день способ создать эффективный препарат для его лечения. Расскажите, пожалуйста, как создаются биофармацевтические препараты.
– Биофармацевтические препараты на данный момент составляют по разным оценкам около 70% всей большой фармы. Создание препаратов для персонализированной медицины основано на технологиях получения сложных молекул, идентичных тем, что уже есть в живых организмах. Такие препараты получаются биологическим путем с использованием специальных клеток-помощников. В них трансфицируется генетический материал, на основе которого идет наработка рекомбинантного белка. Производство таких антител делится на два больших этапа. Первый этап называется Upstream, когда происходит рост клеток в биореакторах, где они активно делятся в питательной среде.
Сейчас для производства, например, моноклональных антител [*используются для терапии рака, прим. ред.] прибегают к одноразовым технологиям — стерильным пластиковым системам (мешкам), которые помещают в волновой или вертикальный (с магнитной мешалкой) биореактор. В данных стерильных мешках выращивают клеточную культуру, объем которой начинается всего с нескольких миллилитров и может доходить до сотни литров. В результате жизнедеятельности и роста клеток происходит наработка биофармацевтического продукта (рекомбинантного белка), который необходимо очистить от примесей (питательная среда, клетки и т.д.) в процессе второго этапа, называемого Downstream, с помощью различных видов препаративной хроматографии и фильтрации. Конечным результатом этого этапа производитель получает готовую субстанцию в сухом виде, с которой можно проводить манипуляции: растворять, упаковывать и т.д.
– Екатерина, что такое принцип 4П в современной медицине?
– Тренды, которые есть в России на сегодня, это персонализация — индивидуальный подход к пациенту, предикция — ранние скрининги и выявление предрасположенности к заболеваниям, превентивность — создание профилактических мер и партисипативность — вовлечение пациента в процесс лечения. Персонификацию можно рассмотреть на примере иммунотерапии, которая действует на конкретного пациента, например CAR-T-терапии при лечении онкологических заболеваний.
 – Расскажите, пожалуйста, подробнее.
– Расскажите, пожалуйста, подробнее.
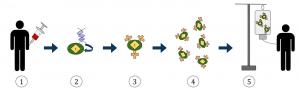
– Первый успешный случай применения CAR-T-терапии был зафиксирован у Эмили Вайтхэд в США, когда удалось вылечить острый рак крови у ребенка. Когда пациент приходит в больницу, у него отбирают кровь из вены. После этого из крови необходимо выделить Т-лимфоциты, модифицировать их, нарастить в достаточной для терапии дозе и вернуть (инъецировать) пациенту. Большая часть процесса должна проходить при помощи биотехнологов. Отобранная кровь поэтапно охлаждается (без использования жидкого азота) до -100 градусов при помощи системы asimptote Via Freeze таким образом, чтобы Т-лимфоциты не потеряли свой функционал. После заморозки кровь помещается в жидкий азот и транспортируется в биотехнологический центр, где оттаивается в специальной системе, которая не повреждает функции клеток (Via Thaw). Следующим важным этапом является аферез, когда Т-лимфоциты из образца крови выделяются на проточной центрифуге малого объема (в стерильном замкнутом контуре) Sepax C-Pro. В результате мы получаем лимфоциты, пригодные для генетической модификации. Разные производители по-разному модифицируют лимфоциты (лентивирусный вектор, транспозоны и др.), доставляя генетическую конструкцию, которая заставляет Т-лимфоцит экспрессировать химерный рецептор. Теперь Т-лимфоциты обладают свойствами, необходимыми для борьбы с заболеванием: гиперактивностью и специфичностью против конкретной опухоли.
После наращивается количество уже обладающих нужными свойствами лимфоцитов в специфицированном биореакторе с использованием специальных сред и добавок. Затем препарат отмывается, «собирается урожай» при помощи проточных центрифуг Sepax C-Pro или Sefia, полученный продукт нужной концентрации снова замораживают, возвращая в больницу, где он после оттаивания проходит финальную отмывку и вводится пациенту. Иммунная терапия — многообещающее направление. Хочется верить, что мы вплотную подошли к тому, чтобы научиться эффективно лечить многие страшные заболевания.
Анастасия Тмур
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

