В 1987 году в геноме кишечной палочки Escherichia coli был обнаружен загадочный участок, состоящий из многочисленных повторов. Функция этого участка, названного CRISPR-локусом (произносится «криспер»), долгое время оставалась загадочной. Но в 2005 году сразу несколько групп исследователей установили, что разделяющие эти повторы промежуточные последовательности идентичны последовательностям в геномах бактериофагов и в плазмидах.
Эти данные позволили предположить, что локус CRISPR — часть ранее не известного механизма, который предназначен для защиты бактерий и архей от инфекций. «Тогда же были обнаружены Cas-гены, часто расположенные рядом с CRISPR-кассетами. Группа «Биоинформатика» Евгения Кунина предложила довольно детальную гипотетическую схему механизма действия CRISPR/Cas-систем. Согласно их модели, при попадании вируса в клетку он обнаруживается с помощью белка Cas, использующего синтезированную c CRISPR РНК-копию. Если какой-либо фрагмент генома вируса совпал с записанным в «памяти» CRISPR, Cas разрезает вирусную ДНК и запускает цепь реакций, в результате вся ДНК уничтожается», – рассказывает «Постнаука». (https://postnauka.ru/faq/59807)
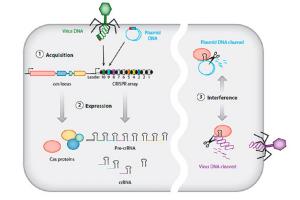 Дальше – больше, в 2012-2013 годах на ее основе были созданы высокоточные инструменты для редактирования генов, причем, не только у бактерий, но и у эукариот. Речь о перепрограммировании системы CRISPR/Cas таким образом, чтобы она стала направленно разрезать ДНК в участках, целенаправленно выбранных исследователем. Сегодня многие ученые склонны считать это почти идеальным инструментом для геномного редактирования.
Дальше – больше, в 2012-2013 годах на ее основе были созданы высокоточные инструменты для редактирования генов, причем, не только у бактерий, но и у эукариот. Речь о перепрограммировании системы CRISPR/Cas таким образом, чтобы она стала направленно разрезать ДНК в участках, целенаправленно выбранных исследователем. Сегодня многие ученые склонны считать это почти идеальным инструментом для геномного редактирования.
Существуют три основных направления применения технологии редактирования ДНК, над которыми непосредственно работают многие лаборатории. Первое – это генная терапия, то когда плохой ген (или его участок) вырезается и заменяется хорошим. Второе направление – синтетическая биология — огромная область, которая занимается тем, что модифицирует геном — в основном бактерий или дрожжей — таким образом, чтобы они начинали синтезировать вещество, которое до этого никто не мог синтезировать. До CRISPR это была традиционная генная инженерия, а теперь это все можно делать в клетке. И третье очень важное направление — это создание животных моделей человеческих болезней.
Не удивительно, что многие генетики ждут от развития технологии CRISPR/Cas9 прорывных результатов уже в ближайшие годы. Впрочем, есть свои аргументы и у скептиков.
О том, какие перспективы открывает новая технология и какие «подводные камни» могут ждать человечество на этом пути, говорили участники панельной дискуссии, прошедшей на одной из площадок фестиваля EUREKA!FEST-2016 (проведенной сразу после небольшой видеолекции одного из создателей технологии – Евгения Кунина). В обсуждении приняли участие науч. сотр. Института химической биологии и фундаментальной медицины СО РАН, профессор Дмитрий Жарков, директор Химико-биологического института БФИ им. И. Канта, член рабочей группы НТИ НейроНет Максим Патрушев и н. с. лаборатории возрастной психогенетики Психологического института РАО Илья Захаров.
Признавая за CRISPR/Cas9 огромные возможности, эксперты, тем не менее, предложили не считать ее панацеей.
– Это не первая технология геномного редактирования, – напомнил Максим Патрушев. – Вначале для этих целей применяли белки с так называемыми цинковыми пальцами, чуть позже научились редактировать геном с помощью TALEN-белков. И про каждую технологию говорили: за ней будущее. Теперь появился CRISPR/Cas9. Да, инструмент более точный, и есть основания считать, что он позволит решить многие задачи, прежде всего в деле создания новых сортов сельскохозяйственных культур и в выведении новых пород животных. А вот в медицине ждать каких-то прорывов в ближайшие годы не стоит.
По мнению экспертов, оснований у такого скептицизма несколько. Одна из главных проблем – точность воздействия. Геном эукариот (организмов, чьи клетки содержат ядро), в тысячу раз длиннее, чем у бактерий и архей. А значит, на несколько порядков выше вероятность внести изменения и в те участки генома, где это не требовалось. Эту проблему еще только предстоит решить.
 Не лучше и ситуация с определением самих участков, которые надо подвергать редактированию. С растениями ситуация несколько проще, учеными накоплен немалый опыт, технология генетических воздействий отработана годами. И такой инструмент как CRISPR/Cas9 просто позволит селекционерам достигать больших результатов за меньшее время. Потому, кстати, большинство экспертов ждут практических результатов от новой технологии редактирования генома прежде всего в аграрной отрасли.
Не лучше и ситуация с определением самих участков, которые надо подвергать редактированию. С растениями ситуация несколько проще, учеными накоплен немалый опыт, технология генетических воздействий отработана годами. И такой инструмент как CRISPR/Cas9 просто позволит селекционерам достигать больших результатов за меньшее время. Потому, кстати, большинство экспертов ждут практических результатов от новой технологии редактирования генома прежде всего в аграрной отрасли.
Гораздо хуже обстоят дела с этим в медицине, отметил в своем выступлении Дмитрий Жарков:
– Сегодня очень мало заболеваний, где мы достаточно хорошо знаем, что именно надо менять в геноме. Большинство генетических заболеваний до конца не изучено. Хотя, возможно, ряд из них и будет ликвидирован в ближайшем будущем, но говорить о полной победе над наследственными заболеваниями пока не приходится. Тем более, об «изменении природы человека», на которую рассчитывают некоторые технооптимисты. Мы вообще мало понимаем, как одно изменение в геноме отзовется на совокупности признаков организма.
Потому, кстати, применение CRISPR/Cas9 для редактирования генома имеет, помимо технологических, юридические ограничения. Сегодня работы с человеческим эмбрионом (речь исключительно об эмбрионах, которые были вживлены в ходе процедуры ЭКО, но затем не «пошли в дело») разрешены только в Великобритании и Китае. И даже среди ученых нет единого мнения по этому поводу, поскольку эта проблема выходит за рамки чисто научной. По сути, мы начинаем вмешиваться в дело формирования популяционного фонда человечества. И нет возможности выяснить, как это отзовется на людях.
Для достоверного ответа потребовались бы два человечества: одно, подвергшееся редактированию, и другое – «чистое», а также сотни лет наблюдений (поскольку изменения в популяции часто происходят достаточно медленно, хоть и не становятся от этого менее значимыми). Очевидно, что условия невыполнимы, а значит, нам остается лишь гадать. Или решать проблему с позиций этики: вправе ли люди вмешиваться в эту сферу, присваивая себе роль Творца.
Однако и полного запрета геномного редактирования с использованием CRISPR/Cas9 опасаться не стоит. Слишком выгодные результаты они могут принести, как в сельском хозяйстве, так и в лечении ряда наследственных заболеваний, например, гемофилии или синдрома Лея. Поэтому, кстати, недавно в правительстве России разъяснили, что объекты, полученные посредством CRISPR/Cas9, не попадают под определение ГМО (поскольку она используется как имитация природной мутации, что применимо в селекции), а потому и запрет на них не распространяется.
Конечно, специалисты понимают, что такое разделение – в определенном роде уловка, чтобы обойти запрет. Но уловка вынужденная. Решить задачу продовольственной безопасности и импортозамещения в отечественном сельском хозяйстве невозможно. И поэтому запрещать работы по редактированию генома в ближайшие годы было бы нелогично.
Да и, как учит нас история, нет успешных примеров, когда юридические или этические барьеры могли бы остановить развитие какой-то результативной технологии в мировом масштабе. Достаточно вспомнить атомную бомбу или работы по клонированию живых организмов. Тут скорее важно соблюсти «золотую середину»: не выпасть из мейнстрима глобального научно-технического прогресса, но при этом не превратить страну в «испытательный полигон» для проверки новых технологических решений. Задача непростая и для ее решения требуется, чтобы политику государства в этой сфере определяли люди с соответствующими компетенциями. Насколько компетентны наши чиновники, вопрос спорный. С учеными все более определенно, и роль, которую сыграла группа под руководством Евгения Кунина в появлении новой технологии редактирования генома, это в очередной раз доказала.
Георгий Батухтин
- Войдите или зарегистрируйтесь, чтобы отправлять комментарии

